商机详情 -
四川生物制品宿主细胞残留DNA检测销售厂家
来源:
发布时间:2025年08月11日
宿主细胞残留 DNA 检测稳定性由三方面决定。样本核酸处理可选用磁珠法或碘化钠法,提取方式有手工或自动化,关键是要有效去除杂质抑制物,且适配复杂样本,保障后续检测基础;qPCR 检测试剂盒涉及标准品,以及含 Mastermix、引物、探针、缓冲液、稀释液的反应体系,其质量与配置影响检测准确度;检测系统主要是 qPCR 仪器,仪器性能与稳定性关乎检测数据可靠性。三者协同,从样本处理、试剂质量到检测设备,共同构建宿主细胞残留 DNA 检测稳定体系 。
rHCDpurify®前处理系统符合21CFR Part11要求,保证数据完整性和可追踪性。四川生物制品宿主细胞残留DNA检测销售厂家
宿主细胞残留 DNA 检测存在多种常见问题。首先,扩增异常表现为扩增曲线异样,扩增效率不达标,检测值也会出现异常;第二,回收异常指回收过程有状况,回收率偏高或偏低;第三,污染问题是 NTC(无模板对照 )、NCS(阴性对照 )出现有值情况,干扰检测;第四,设备使用异常则因前处理设备、PCR 设备操作不当,致使检测结果异常。这些问题从扩增、回收、污染到设备操作,多环节影响检测准确性,需在实验中针对性排查、解决,保障宿主细胞残留 DNA 检测结果可靠 。
湖北Vero宿主细胞残留DNA检测针对宿主细胞残留DNA检测,湖州申科生物还提供技术服务,包括HCD特定开发、方法学验证等。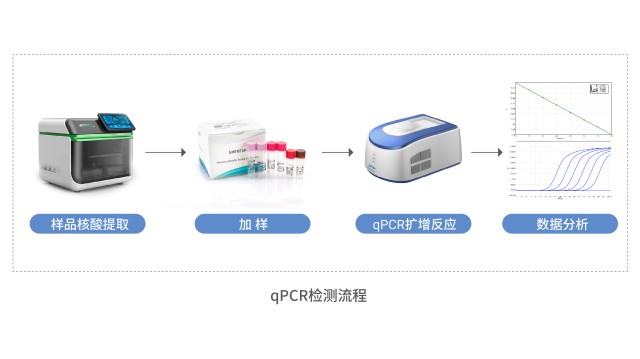
美国食品药品监督管理局(FDA)提醒使用HEK293T细胞生产病毒载体时因存在SV40 T抗原,还需要检测残留的腺病毒E1(E1A & E1B)和SV40 T抗原序列。《中国药典》有关生物制品宿主残留核酸质量控制要求和CDE颁布的《细胞***产品申请临床试验药学研究和申报资料的考虑要点》中关于质粒和病毒载体的质量标准也提到,如使用HEK293细胞进行病毒载体生产,需进行宿主细胞残留DNA检测和RNA残留、SV40大T抗原DNA残留、E1A和E1B基因DNA残留检测。
宿主细胞残留DNA检测的样品处理环节是决定检测准确性的关键步骤,其技术难点贯穿于核酸释放、纯化和去除干扰物的全过程。生物制品基质复杂多样,不同类型样品(如疫苗、单抗、干细胞、免疫细胞类产品)对处理方法的要求差异明显:疫苗样品常含高浓度灭活剂(如甲醛)和佐剂(如铝盐),易导致DNA吸附或降解;单抗样品中的高蛋白浓度(10-100 mg/mL)会竞争性结合磁珠,降低提取效率;干细胞、免疫细胞类产品则可能残留二甲基亚砜(DMSO),直接抑制PCR反应。
SHENTEK® 系列宿主细胞残留DNA检测试剂盒专属性强,不受其他工程细胞基因组干扰。
宿主细胞残留 DNA 检测体系(qPCR 法)技术关键点涵盖多方面。首先是靶标序列查找及确定,需依据宿主物种基因组序列,筛选物种特异、高度重复且散在分布的序列作为靶标 。其次是检测体系建立和方法验证,要在合适位点设计引物与探针,选适配荧光和淬灭基团,基于 qPCR 法优化体系组分比例,得到 MIX 用于微量 DNA 模板检测,同时验证线性范围、专属性等多项指标 。还需确保检测体系稳定,做好参考品准确标定、控制试剂批间差异 。另外,要有合适的宿主细胞残留 DNA 提取体系,应对不同样品基质影响,回收提取微量残留 DNA 并纯化 。
单克隆抗体与重组蛋白药物领域,需检测 CHO 细胞等残留 DNA,把控药物安全与有效性。上海Vero宿主细胞残留DNA检测随着国内外监管趋严,生物制品中宿主细胞残留DNA作为关键质量属性,将持续受到关注与严格控制。四川生物制品宿主细胞残留DNA检测销售厂家
SHENTEK® Vero残留DNA检测试剂盒用于定量检测各种生物制品的中间品、半成品和成品中Vero宿主细胞DNA的试剂盒。本试剂盒利用荧光探针原理,定量检测样品中 Vero 残留 DNA。检测快速,专一性强,性能稳定可靠,检测限可以达到 fg 水平。试剂盒配套有Vero DNA 定量参考品。本试剂盒与SHENTEK®宿主细胞残留 DNA 样本前处理试剂盒配套使用,整个分析系统通过优化前处理与检测步骤的兼容性,明显提升对Vero细胞微量 DNA 残留的回收率与定量准确度。
四川生物制品宿主细胞残留DNA检测销售厂家
标签:
宿主细胞蛋白(HCP)残留检测
下一篇:
吉林CHO宿主细胞残留DNA检测销售厂家